- Biography
- Works
- Contact
Les informations ci-après se réfèrent à la date de la remise du Prix.
Citoyen américain, né en 1948, Timothy J. RICHMOND travaille en Europe depuis 1978. Il est professeur de cristallographie de macromolécules biologiques à l’Ecole polytechnique fédérale de Zurich.
Dans le noyau cellulaire, l’ADN interagit avec des protéines nucléaires spécialisées pour créer une structure hautement compacte et organisée appelée la chromatine. L`unité de base de la chromatine est le nucléosome qui se compose d’un complexe d’octamères d’histones sur lequel est enroulé l’ADN. Une chaîne de nucléosomes, placés environ toutes les 200 paires de bases, constitue un nucléofilament qui peut se condenser pour former une fibre de chromatine. Le processus dynamique d’assemblage et de désassemblage de ces fibres pourrait définir l’accessibilité de l’ADN à des facteurs de transcription et jouer un rôle clé dans la régulation des gènes. Timothy J. RICHMOND et son équipe ont fait appel à la biologie moléculaire et à la cristallographie aux rayons X pour identifier la structure du nucléosome, un projet ambitieux qui a démarré il y a plus de dix ans. Le nucléosome est le plus gros complexe de protéines-ADN jamais analysé avec une telle précision. Cette analyse est une étape importante dans notre compréhension de la chromatine. Timothy J. RICHMOND a également réalisé des images à haute définition de plusieurs facteurs de transcription et de leur interaction avec l’ADN (p.ex. le SRF et le TCF).
Timothy J. RICHMOND se propose d’utiliser le Prix Louis-Jeantet de médecine pour étudier la structure d’une fibre de chromatine et son interaction avec les complexes de remodelage, afin de découvrir comment ceux-ci modifient la chromatine. Cela devrait permettre de mieux comprendre les principes selon lesquels des facteurs de transcription accèdent à l’ADN sur des sites spécifiques de la régulation génétique. Timothy J. RICHMOND prévoit de recruter un nouveau collaborateur et d’acquérir les nouveaux instruments nécessaires pour mener à bien cette étude.
Notice biographique
De nationalité américaine, Timothy J. Richmond est né en 1948. Il a fait ses études de biochimie à l’Université Purdue à West Lafayette, Etats-Unis, et obtenu son doctorat en 1975 à l’Université Yale à New Haven, Etats-Unis. Il a effectué ses travaux de recherche post-grade avec F. M. Richards à l’Université Yale, et de 1978 à 1980, avec A. Klug au Medical Research Council Laboratory of Molecular Biology à Cambridge, Grande-Bretagne. En 1980, il est recruté en tant que responsable de recherche dans cet institut. En 1987, il est nommé professeur de cristallographie de macromolécules biologiques à l’Institut de biologie moléculaire et de biophysique de l’Ecole polytechnique fédérale de Zurich (ETHZ), Suisse. Timothy J. Richmond est membre élu de la European Molecular Biology Organisation (EMBO) et de l’Academia Europeae.
Structure de la chromatine et expression des gènes
Les cellules des organismes eucaryotes contiennent des milliers de gènes qui codent l’information nécessaire aux processus vitaux. Or, une petite partie seulement de ces gènes sont actifs à un moment donné. Les gènes humains, qui sont au nombre de 35’000 environ, sont inclus dans un génome d’ADN de plus de 3 milliards de paires de bases (les bases sont les lettres génétiques épelant le code génétique). L’ADN d’un noyau pourrait s’étendre sur une distance de deux mètres si les histones ne le condensaient pas en un millionième de cette grandeur. Les histones sont présentes dans tous les organismes supérieurs où elles forment des nucléosomes toutes les 200 paires de bases environ le long de l’ADN. Le nucléosome est l’unité de base répétée de la chromatine, à savoir le constituant principal des chromosomes. La chromatine se compose aussi d’une variété de protéines non-histones beaucoup moins nombreuses, dont certaines sont importantes pour spécifier quels gènes seront transcrits (copiés par synthèse d’ARN messager) en réponse aux besoins du métabolisme cellulaire, du cycle cellulaire, ou du développement de l’organisme.
Pour comprendre la régulation biologique il est indispensable de savoir comment se fait l’activation génétique sélective dans un vaste génome maintenu dans un état fortement condensé. La connaissance de ces processus aura des retombées majeures sur le traitement des maladies humaines grâce aux progrès qu’elle permettra de réaliser en médecine moléculaire. Ces progrès dépendent de notre capacité à découvrir les mécanismes en question, dont la compréhension dépend, à son tour, de notre connaissance approfondie de la structure moléculaire. On a montré ces dernières années que les histones ne se contentent pas de freiner l’activité des gènes, mais qu’assemblées en nucléosomes elles collaborent avec des protéines (les facteurs de transcription) qui ont pour fonction d’activer ou de désactiver des gènes. On pense que cette commutation régulatrice est facilitée par des changements réversibles survenant dans la chromatine entre sa forme ouverte ou condensée. La sélectivité est obtenue par différentes combinaisons de facteurs de transcription qui s’assemblent de manière coopérative près de leurs gènes-cibles. Une seconde catégorie de ces facteurs marquent l’endroit où sera initiée la transcription produisant ainsi un second site de contrôle.
Timothy J. Richmond et ses collègues ont fait appel à la biologie moléculaire et à la cristallographie aux rayons X pour découvrir les structures atomiques nécessaires à l’emballage de l’ADN dans la chromatine et au mécanisme de la régulation génique dans le cadre de la chromatine. Ils ont élucidé la structure de la partie centrale du nucléosome, comprenant la majeure partie de celui-ci. Il s’agit du plus grand complexe protéines-ADN (206 kilodaltons) dont on a obtenu à ce jour une image atomique en trois dimensions. Ce complexe comprend deux copies de chacune des quatre histones et 147 paires de bases d’ADN. Le groupe de Timothy J. Richmond a également réalisé des images à haute définition de complexes comprenant l’ADN avec deux facteurs de transcription, tels que le Serum Response Factor (SFR) et la protéine 1 associée au SRF (SAP1) ou le facteur de transcription IIA (TFIIA) et la protéine TATA-box (TBP). Les structures de ces complexes permettent de mieux comprendre les causes d’une reconnaissance spécifique sur les régions régulatrices de l’ADN, ainsi que l’association coopérative des facteurs.
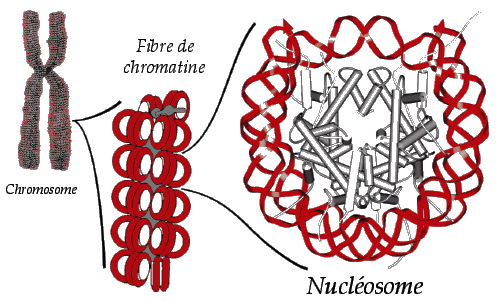
Figure 1 : De la levure jusqu’à l’homme, l’ADN est empaqueté dans les chromosomes sous forme d’une structure hiérarchique, la chromatine. La structure cristalline analysée par rayons X d’un nucléosome montre l’arrangement atomique des histones ( ![]() ) et de l’ADN (
) et de l’ADN ( ![]() ) au niveau d’organisation le plus élémentaire.
) au niveau d’organisation le plus élémentaire.

Figure 2 : Les facteurs de transcription s’associent de façon coopérative à des endroits spécifiques sur le génome afin de réguler l’expression des gènes. La structure formée du Serum Response Factor (SRF ![]() ), de la protéine associée à SRF (SAP1
), de la protéine associée à SRF (SAP1 ![]() ) et de l’ADN montre comment ces protéines sont tenues ensemble par une liaison flexible et par la séquence de la SAP1 ” B-box “.
) et de l’ADN montre comment ces protéines sont tenues ensemble par une liaison flexible et par la séquence de la SAP1 ” B-box “.
Professeur Timothy J. RICHMOND
Institute for Molecular Biology and Biophysics
ETH – Zurich
Tél.: +41 1 633 24 70
Fax: +411 633 11 50
E-mail: richmond@mol.biol.ethz.ch
Site Internet :
www.mol.biol.ethz.ch/
