- Biographie
- Travaux
- Contact
Les informations ci-après se réfèrent à la date de la remise du Prix.
Citoyen britannique, né en 1952, Alan HALL est professeur de biologie moléculaire et directeur du Laboratoire de Biologie Cellulaire et Moléculaire et de l’Unité de Biologie Cellulaire du Medical Research Council au University College de Londres.
Composé d’actine et de myosine, le cytosquelette joue un rôle important dans l’adoption par les cellules épithéliales de la polarité cellulaire correcte, qui leur permet de se lier fermement les unes aux autres pour créer une couche de cellules. Le cytosquelette est également fortement modifié lorsque les cellules migrent. Alan HALL reçoit le Prix Louis-Jeantet pour sa découverte que certaines enzymes, des petites GTPases connues sous le nom de Rho et de Rac, modifient localement l’assemblage du cytosquelette et contrôlent ainsi l’adhérence et la migration cellulaires. L’invasion tumorale nécessitant une inhibition de l’adhérence cellulaire et une augmentation de l’activité migratoire des cellules, le travail de recherche mené par Alan HALL est d’une grande importance pour comprendre comment les tumeurs épithéliales deviennent métastatiques. Alan HALL est particulièrement intéressé à trouver les altérations génétiques qui affectent les voies de signalisation des Rho GTPases de façon à modifier le contrôle du cytosquelette et permettre ainsi aux cellules tumorales épithéliales de s’échapper de la tumeur primaire.
Avec les moyens mis à disposition par le Prix Louis-Jeantet de médecine, Alan HALL souhaite poursuivre sa recherche sur la façon dont s’établit la spécificité des Rho GTPases pour leurs cibles. A cette fin, il prévoit d’augmenter ou de diminuer l’expression d’environ 85 différents facteurs humains d’échange des nucléotides de guanine, facteurs qui coopèrent potentiellement avec les Rho GTPases, et de tester comment ces enzymes influencent les propriétés migratoires des cellules tumorales. Alan HALL prévoit d’agrandir son équipe par l’engagement de deux nouveaux collaborateurs.
Notice biographique
Alan Hall a fait des études de chimie à l’Université d’Oxford et a obtenu son PhD de chimie en 1977 à l’Université Harvard de Boston. Comme postdoctorant, il a rejoint le Département de biologie moléculaire de l’Université d’Edinbourg et l’Institut de biologie moléculaire de l’Université de Zurich. En 1981, il est devenu chef de groupe aux Laboratoires Chester Beatty de l’Institut de Recherche sur le Cancer à Londres. Il a été nommé professeur de biologie moléculaire au University College de Londres en 1993 et Directeur du Laboratoire de Biologie Cellulaire et Moléculaire et de l’Unité de Biologie Cellulaire du Medical Research Council, au sein de cette même institution, en 2001. Il a reçu le Prix Feldberg en 1993. Il est membre de l’EMBO et Fellow de la Royal Society.
La biologie cellulaire de l’invasion tumorale
Le développement du cancer humain implique l’accumulation de changements génétiques multiples qui modifient le comportement des cellules. Au cours des vingt dernières années, de nombreux gènes à l’origine du cancer ont été identifiés et ceux qui ont été le mieux compris sont ceux qui affectent la prolifération cellulaire. Par exemple, des mutations ont été trouvées dans des gènes qui codent pour des protéines impliquées dans les voies de signalisation, comme les récepteurs de la surface membranaire, les kinases cytoplasmiques ou les GTPases régulatrices, ainsi que dans le contrôle du cycle cellulaire, comme les cyclines ou les facteurs de transcription. Néanmoins, la faculté des cellules à se diviser de façon incontrôlable n’est pas suffisante pour entraîner la croissance d’une tumeur – des changements tels que ceux qui provoquent une instabilité génétique additionnelle, surmontent les programmes de mort cellulaire ou induisent l’angiogenèse (formation de vaisseaux sanguins) sont également nécessaires. Même ainsi, la formation de la masse tumorale n’est qu’un aspect de la maladie. Une phase métastatique beaucoup plus menaçante pour la vie peut suivre, lorsque des cellules individuelles se détachent, émigrent de la tumeur originelle et envahissent les tissus avoisinants et le stroma. Ces cellules pénètrent ainsi les vaisseaux sanguins ou lymphatiques et sont transportées à travers le corps où elles forment des tumeurs secondaires disséminées.
Pendant la première phase de la croissance tumorale, les interactions entre cellules tumorales sont maintenues et ressemblent souvent à celles que l’on observe dans le tissu normal correspondant. Dans les tumeurs épithéliales (les plus communes des tumeurs humaines), les jonctions entre cellules, qui dépendent de la cadhérine, sont toujours présentes et contribuent à maintenir une masse tumorale physiquement bien distincte. Les étapes génétiques qui facilitent la progression métastatique sont mal comprises, elles sont entre autres à l’origine de la destruction des interactions entre cellules dans la tumeur primaire et de l’augmentation de leur activité migratoire, avec pour résultat que les cellules tumorales s’échappent et envahissent les tissus voisins (Figure 1).
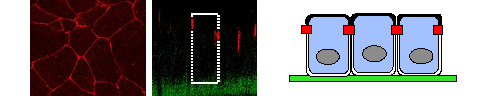
Figure 1: A gauche: vue d’en haut d’une couche de cellules épithéliales. Les jonctions entre cellules dues à la cadhérine (en rouge) sont visibles au microscope. Au milieu: vue de côté de la même couche de cellules épithéliales. Les contours d’une cellule dans la couche sont marqués avec une ligne discontinue en blanc. A droite: vue schématique d’une monocouche de cellules épithéliales. Les jonctions dues à la cadhérine (en rouge) procurent une forte interaction entre cellules et maintiennent l’intégrité du tissu. Elles génèrent la polarité cellulaire où chaque cellule possède un haut côté (en noir) et un bas côté (en blanc). La destruction des jonctions a lieu pendant la phase métastatique de la progression cancéreuse et permet aux cellules de s’échapper. Le noyau de la cellule est figuré en gris.
Au cours des quinze dernières années, le laboratoire d’Alan Hall a travaillé sur la famille de protéines connue sous le nom de Rho-GTPases. Il a été le premier à décrire deux voies de signalisation distinctes selon lesquelles ces protéines influencent l’organisation du cytosquelette d’actine. La première de ces protéines, Rho, contrôle l’assemblage des filaments contractiles d’actine et de myosine dans la cellule, alors que la seconde, Rac (un autre membre de la famille) induit la polymérisation de l’actine et la formation de filaments en bordure de la cellule. Alan Hall, ainsi que d’autres chercheurs ont pu montrer que ces deux activités contrôlent la forme et les propriétés migratoires des cellules animales (Figure 2).

Figure 2: Les filaments d’actine (en blanc) sont visualisés par microscopie. En haut à gauche: une cellule immobile en l’absence d’un stimulus. La cellule contient très peu d’actine organisée. En haut à droite: la même cellule stimulée pour activer Rho. La cellule a assemblé les filaments d’actine et de myosine qui la traversent. Ces filaments génèrent une force contractile qui tire les bords de la cellule vers l’intérieur. En bas à gauche: la même cellule stimulée pour activer Rac. Les filaments d’actine sont assemblés juste sous la périphérie, poussant les bords de la cellule vers l’extérieur. En bas à droite: image tirée d’un film montrant la cellule qui migre dans la direction indiquée. Le front de la cellule est poussé en avant par la formation de filaments induite par Rac, pendant que le centre et l’arrière de la cellule se resserrent dans le même sens, sous l’effet des forces contractiles induites par Rho.
Plus récemment, d’autres fonctions ont pu être attribuées au Rho GTPases, y compris un rôle dans le renforcement de l’adhésion entre cellules immobiles. Cette capacité remarquable de pouvoir contrôler des activités qui semblent opposées nous interroge. Elle reflète probablement les différents contextes biochimiques et biologiques dans lesquels agissent les Rho GTPases. Puisque l’invasion tumorale nécessite l’inhibition de l’adhésion entre cellules, ainsi que la stimulation de la migration cellulaire, les contributions des Rho GTPases et de leurs voies de signalisation au phénotype métastatique sont du plus haut intérêt.
Alan Hall et son équipe travaillent avec des cellules normales et des cellules dérivées de tumeurs, afin d’examiner, dans des essais de tissus en culture, la fonction des Rho GTPases pendant la migration cellulaire et lors de l’assemblage des jonctions entre cellules épithéliales. Lors d’expériences récentes, ils ont identifié deux protéines, l’APC et la Dlg, qui sont requises pour la migration directionnelle des cellules normales. Il y a deux aspects étonnants à ces observations. Premièrement, tant l’APC que la Dlg agissent comme des suppresseurs de tumeurs, c’est-à-dire qu’elles inhibent la prolifération cellulaire, et, en fait, le gène de l’APC est muté dans beaucoup de cancers humains. Deuxièmement, la Dlg a déjà été décrite comme une protéine augmentant l’adhésion entre cellules épithéliales. Ceci suggère un mécanisme commun inattendu reliant le processus de la migration cellulaire à la fois à l’adhésion entre cellules et à la prolifération cellulaire. Alan Hall tente aujourd’hui de comprendre les voies de signalisation par lesquelles les Rho GTPases contrôlent la migration et l’adhésion de cellules normales et comment ces processus sont modifiés dans les cancers humains invasifs.
Professeur Alan Hall
Professeur de biologie moléculaire
Directeur
MRC Laboratory for Molecular Cell Biology & Cell Biology Unit
University College London
Gower Street
UK – LONDON WC1E 6BT
Téléphone: +44 20 7679 7909
Télécopie: +44 20 7679 7804
Courriel: alan.hall@ucl.ac.uk
Site internet: http://www.ucl.ac.uk/lmcb/
