- Biographie
- Travaux
- Contact
Les informations ci-après se réfèrent à la date de la remise du Prix.
Né en 1954 à Münster, Peter Hegemann a étudié la chimie dans sa ville natale ainsi qu’à Munich, où il a aussi obtenu un doctorat en biochimie. Il est ensuite parti aux Etats-Unis faire son travail postdoctoral à l’Université de Syracuse (Etat de New-York). De retour en Allemagne en 1986, il a dirigé un groupe de recherche à l’Institut Max-Planck de biochimie, puis il a été nommé professeur de biochimie à l’Université de Regensburg. Depuis 2004, il est professeur de biophysique expérimentale à l’Université Humboldt de Berlin. Peter Hegemann est membre de l’Académie allemande des sciences, Leopoldina.
Georg Nagel est né en 1953 à Weingarten près de Ravensburg. Il a étudié la biologie et la biophysique à l’Université nouvellement créée de Constance. Après avoir enseigné quelques années dans un collège en Suisse, il a poursuivi sa formation et obtenu un doctorat de biologie et de biophysique à l’Université de Francfort-sur-le-Main en 1988. Il est ensuite parti aux Etats-Unis faire des stages postdoctoraux à l’Université de Yale, puis à l’Université Rockefeller. De retour en Allemagne, en 1992, il a dirigé un groupe de recherche au département de chimie biophysique à l’Institut Max-Planck de biophysique. Depuis 2004, il est professeur de physiologie moléculaire végétale et de biophysique à l’Université de Würzburg (Bavière).
Peter Hegemann et Georg Nagel ont déjà partagé plusieurs distinctions, notamment le Prix Wiley en sciences biomédicales aux Etats-Unis (2010) et les Prix Karl-Heinz-Beckurts (2010) et Klaus-Joachim-Zülch en Allemagne (2012).
De l’algue verte aux neurosciences
Tout a commencé dans les années 1980, lorsque Peter Hegemann a cherché à comprendre comment une microscopique algue verte, Chlamydomonas reinhardtii, parvenait à s’approcher ou à s’éloigner d’une source lumineuse. Après une dizaine d’années de recherches, il a proposé une hypothèse: un complexe protéique, formé d’une rhodopsine et d’un canal ionique, dépolarise la membrane de l’algue, ce qui est perçu par les flagelles. Ces dernières modifient alors leur mouvement, en fonction de l’intensité et de la couleur de la lumière. Peter Hegemann a identifié les gènes de la rhodopsine dans une banque de gènes japonaise et les a envoyés à Georg Nagel. Ce dernier a réussi à exprimer les protéines rhodopsines dans des cellules animales, ce qui lui a permis d’étudier en détail leur fonctionnement. Il a ainsi confirmé l’hypothèse émise par Peter Hegemann et l’a même étendue en démontrant que les rhodopsines – qu’il a appelées les Channelrhodopsines – fonctionnaient comme des canaux ioniques actionnés par la lumière.
Comme les deux biochimistes l’avaient suggéré, ce mécanisme n’est pas spécifique aux algues. Les Channelrhodopsines peuvent aussi être exprimées dans les cellules nerveuses (neurones) de nombreuses espèces animales – des vers aux primates – qu’elles rendent sensibles à la lumière. Cela permet d’étudier les fonctions de certains neurones dans le contexte de leur réseau.
Les deux scientifiques allemands ont ainsi été les pionniers d’une nouvelle discipline, l’optogénétique, que la revue Nature Methods a élue «Méthode de l’année» en 2010. Il est en effet apparu que la lumière pouvait activer les neurones des espèces supérieures, ce qui ouvre la voie à de multiples applications médicales. On peut espérer notamment pouvoir utiliser des impulsions lumineuses pour redonner une vision rudimentaire aux personnes aveugles, pour stimuler le cerveau profond de patients atteints de la maladie de Parkinson, ou encore pour agir sur le rythme du cœur, afin de traiter l’insuffisance cardiaque.
Une algue verte qui se déplace sous l’effet de la lumière
Pour de nombreuses personnes, le mot algue n’évoque que de l’écume à la surface des étangs. C’est d’ailleurs cette dernière expression que l’éditorialiste de la revue Nature Methods a employée lorsqu’il a loué, en 2010, les travaux de Peter Hegemann et de Georg Nagel.
L’écume en question se nomme en fait Chlamydomonas reinhardtii. Cette algue verte microscopique est un modèle très prisé par les chercheurs qui l’utilisent pour étudier les processus biologiques fondamentaux comme la photosynthèse, la division cellulaire, le mouvement des flagelles ou la mobilité des organismes.
Cette algue a une autre particularité: ses mouvements sont contrôlés par la lumière. Afin de tenter de comprendre ce phénomène, Peter Hegemann a entrepris, dans les années 1980, d’examiner les mécanismes qui rendent Chlamydomonas reinhardtii photosensible.
L’un des membres de son équipe a ainsi été le premier à étudier l’électrophysiologie de cette algue. Après avoir stimulé cette dernière par des flashs lumineux, il a enregistré le courant électrique issu de son photorécepteur et ceux qui apparaissaient ensuite dans les flagelles de l’algue. Il a ainsi observé que les courants électriques induits par la lumière (photocourants) dépendaient de l’intensité lumineuse et qu’ils modifiaient les battements des flagelles et, de ce fait, l’orientation de l’algue par rapport à la lumière.
Etant donné la rapidité avec laquelle le photocourant était généré, Peter Hegemann et ses collègues ont émis l’hypothèse que le photorécepteur de l’algue était constitué d’une rhodopsine associée à un canal ionique, l’ensemble formant un unique complexe protéique.
Les rhodopsines microbiennes
Les rhodopsines sont des protéines sensibles à la lumière qui ont pour la première fois été découvertes dans les rétines d’animaux. Elles sont formées d’une protéine (l’opsine) et de retinal (vitamin A). Indirectement, les rhodopsines modulent les canaux ioniques qui transportent les ions sodium, calcium et potassium à travers les membranes. Etonnamment, on a aussi retrouvé ces rhodopsines chez des archaebactéries, des microorganismes qui parviennent à survivre dans des conditions environnementales extrêmes en capturant l’énergie du soleil à l’aide d’un genre particulier de rhodopsines dites «microbiennes».
Georg Nagel a été le premier à transplanter (via un transfert de gène) des rhodopsines microbiennes dans des cellules animales et à montrer qu’elles étaient fonctionnelles dans cet environnement qui leur était inhabituel. Cela lui a permis d’étudier de près ces rhodopsines et de mettre en évidence certaines de leurs propriétés qui étaient jusqu’alors inconnues.
Pendant des années, Peter Hegemann et son équipe ont tenté de purifier le photorécepteur de Chlamydomonas, mais du fait de l’instabilité et de l’hétérogénéité des protéines impliquées, ces travaux n’ont pas abouti.
Tout s’est dénoué en 2001, lorsqu’un collègue de Peter Hegemann a identifié une nouvelle séquence, proche de celle d’une rhodopsine microbienne, dans l’ADN deChlamydomonas appartenant à une banque de gènes d’un centre de recherche japonais. C’est alors que Peter Hegemann a initié sa première collaboration avec Georg Nagel, en lui envoyant deux de ces séquences d’ADN.
Georg Nagel était déjà un électrophysiologiste réputé qui s’intéressait au transport des ions (des sels) à travers les membranes des cellules. Il avait notamment étudié la régulation d’une protéine membranaire humaine nommée CFTR (Cystic Fibrosis Transmembrane conductance Regulator), qui est défectueuse chez les personnes atteintes de mucoviscidose. Comme indiqué, il a aussi fait œuvre de pionnier en parvenant à exprimer la rhodopsine bactérienne dans des cellules animales, en particulier dans les oocytes (cellules sexuelles femelles n’ayant pas encore atteint leur maturité) des crapauds aquatiques d’Afrique australe, que sont les Xenopus laevis.
Les « Channelrhodopsines »
Peter Hegemann et Georg Nagel ont donc des approches complémentaires et leur collaboration sur l’étude des photorécepteurs de l’algue verte Chlamydomonas reinhardtiis’est révélée fructueuse.
Lorsqu’il a reçu les séquences d’ADN de rhodopsines que lui avait transmises Peter Hegemann, Georg Nagel a exprimé les protéines dans les oocytes de Xenopus et a étudié leur fonction. En analysant le courant électrique induit par la lumière, il est arrivé à la conclusion que les rhodopsines de Chlamydomonas forment des canaux ioniques qui ne s’activent et ne permettent le passage des ions à travers les membranes qu’en présence de lumière.
Il a proposé de nommer ces canaux ioniques particuliers «Channelrhodopsines» (ChR), dont les deux biologistes ont découvert deux sortes, ChR1 et ChR2.
La naissance de l’optogénétique
Les chercheurs ont aussi exprimé ChR2 dans des cellules rénales humaines (voir figures A et B). Cela les a conduits à suggérer que ce canal ionique devait être présent dans des organismes autres que l’algue verte Chlamydomonas reinhardtii. Et ils ont vu juste.
Georg Nagel avait en effet collaboré avec Alexander Gottschalk, un neurobiologiste de l’Université de Francfort-sur-le-Main, qui travaillait sur le petit nématode modèle C. elegans. Les deux scientifiques ont exprimé un ChR2 mutant dans des cellules de ce vers et ils ont montré, en 2005, que le comportement du nématode pouvait être modulé par la lumière.
Depuis, de nombreuses autres équipes dans le monde ont démontré que ce canal ionique s’exprimait dans des coupes de cerveau de souris, dans l’épine dorsale d’embryons de poulet et dans la rétine de souris aveugles. C’est ainsi que, grâce aux travaux pionniers de Peter Hegemann et Georg Nagel, est née l’optogénétique, qui a été élue « Méthode de l’année » 2010 par la revue Nature Methods.
Cette nouvelle discipline qui vise à exprimer des protéines photosensibles dans certaines populations de cellules neuronales et à les activer à l’aide d’impulsions lumineuses, ouvre la voie à de nombreuses applications médicales, notamment en neurologie. A l’aide de la lumière, on peut en effet espérer pouvoir un jour redonner une vision rudimentaire aux personnes aveugles, stimuler le cerveau profond de patients atteints de la maladie de Parkinson, mais aussi agir sur le rythme du cœur afin de traiter l’insuffisance cardiaque.
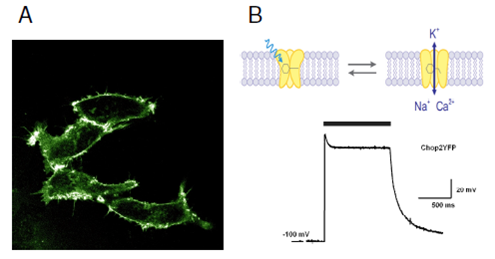
Fig. A
La Channelrhodopsine-2 (ChR2) fusionnée avec une protéine fluorescente (YFP), permet de marquer la membrane délimitant des cellules rénales embryonnaires humaines.
Fig. B
La lumière (indiquée par la barre grise) ouvre le canal cationique ChR2YFP, ce qui conduit à une dépolarisation forte et réversible.
Professeur Peter Hegemann
Experimental Biophysics
Humboldt-Universität zu Berlin
Invalidenstrasse 42
10115 Berlin (Allemagne)
Tél. +49 30 2093 8681 (direct)
Tél. +49 30 2093 8830 (assistante)
hegemann@rz.hu-berlin.de
http://www2.hu-berlin.de/biologie/expbp
Professeur Georg Nagel
Julius-von-Sachs-Institute
Biocenter – University of Würzburg
Julius-von-Sachs-Platz 2
97082 Würzburg (Allemagne)
Tél. +49 931 318 6143 (direct)
Tél. +49 931 318 9199 (assistante)
nagel@uni-wuerzburg.de
http://www.bot1.biozentrum.uni-wuerzburg.de/forschung/nagel/
